- Regla del octeto. Estabilidad atómica.
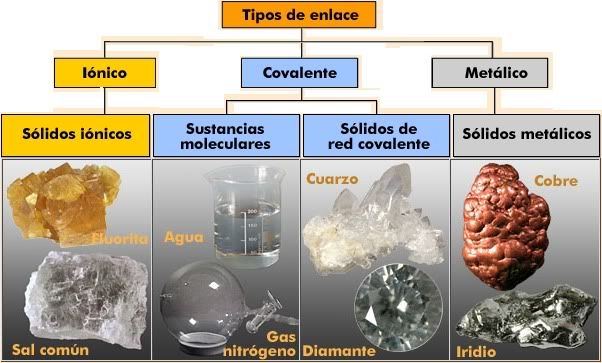
- Tipos de enlaces : iónico, covalente y metálico.
- Propiedades de las sustancias iónicas, covalentes y metálicas.
- Concepto de molécula y cristal.
- La mitocondria. (Respiración celular)
La mayoría de la gente desea una vida estable: estabilidad económica, sentimental........ y los átomos no son menos, también quieren ser estables. Pero ¿cómo consigue ser estable un átomo?.
Bueno, la mayoría de los átomos alcanza la estabilidad pareciéndose a los gases nobles, esto es, consiguiendo tener en la mayoría de los casos ocho electrones en su ultima capa (regla del octeto).
Actividad nº 1: Veamos una posibilidad (que ya ha aparecido en el vídeo anterior). Si ponemos cerca un Metal y un No metal es posible que se pongan muy contentos, ¿por qué te preguntarás?. Pues porque los metales tienen tendencia a ceder electrones y los no metales a ganarlos, de tal manera que se transformarán en iones de carga opuesta y se atraerán formándose un cristal o red cristalina, que será más o menos grande en función del número de iones que lo formen. A la fuerza que los mantiene unidos se le denomina ENLACE IÓNICO.
En esta dirección de "Educaplus" puedes ver una animación.
Actividad nº 2: Segunda posibilidad, cuando los átomos lo que hacen es compartir pares de electrones. Esto ocurre cuando ponemos cerca un No metal con otro No metal. En este caso si se forman verdaderas moléculas. (aunque en algunos casos también se forman redes cristalinas). Y al enlace que les une se le denomina ENLACE COVALENTE.
En este "enlace" de canarias puedes ver una animación.

"referencia imagen"
¿Te animas a "construir moléculas"?
Actividad nº 3: Tercera posibilidad, cuando se encuentran juntos átomos que tienen la misma tendencia a ganar o perder electrones, por ejemplo átomos de un mismo metal, (Metal con Metal). La forma de cumplir la regla del octeto es mediante la compartición de electrones entre muchos átomos. Se crea una nube de electrones que es compartida por todos los núcleos de los átomos que ceden electrones al conjunto. Al enlace se le denomina ENLACE METÁLICO. Los átomos así unidos solo forman cristales.
"Aquí" tienes una animación. En este "enlace" tienes otra animación.
Un resumen antes de seguir: consulta esta dirección de "iniciación interactiva a la materia".
Si te paras a pensar en las miles de sustancias distintas, tanto naturales como artificiales, que hay a tu alrededor, fácilmente caerás en la cuenta de que esto solo es posible porque los átomos, de los cuales solo hay poco más de cien diferentes, se combinan unos con otros dando lugar a nuevas sustancias.
Pero ¿por qué los átomos se unen ?¿de qué manera se enlazan?. Estas y otras preguntas serán contestadas en esta unidad, o al menos se intentará....
Pero ¿por qué los átomos se unen ?¿de qué manera se enlazan?. Estas y otras preguntas serán contestadas en esta unidad, o al menos se intentará....
Bueno, la mayoría de los átomos alcanza la estabilidad pareciéndose a los gases nobles, esto es, consiguiendo tener en la mayoría de los casos ocho electrones en su ultima capa (regla del octeto).
Actividad nº 1: Veamos una posibilidad (que ya ha aparecido en el vídeo anterior). Si ponemos cerca un Metal y un No metal es posible que se pongan muy contentos, ¿por qué te preguntarás?. Pues porque los metales tienen tendencia a ceder electrones y los no metales a ganarlos, de tal manera que se transformarán en iones de carga opuesta y se atraerán formándose un cristal o red cristalina, que será más o menos grande en función del número de iones que lo formen. A la fuerza que los mantiene unidos se le denomina ENLACE IÓNICO.
En esta dirección de "Educaplus" puedes ver una animación.
Actividad nº 2: Segunda posibilidad, cuando los átomos lo que hacen es compartir pares de electrones. Esto ocurre cuando ponemos cerca un No metal con otro No metal. En este caso si se forman verdaderas moléculas. (aunque en algunos casos también se forman redes cristalinas). Y al enlace que les une se le denomina ENLACE COVALENTE.
En este "enlace" de canarias puedes ver una animación.
"referencia imagen"
¿Te animas a "construir moléculas"?
Actividad nº 3: Tercera posibilidad, cuando se encuentran juntos átomos que tienen la misma tendencia a ganar o perder electrones, por ejemplo átomos de un mismo metal, (Metal con Metal). La forma de cumplir la regla del octeto es mediante la compartición de electrones entre muchos átomos. Se crea una nube de electrones que es compartida por todos los núcleos de los átomos que ceden electrones al conjunto. Al enlace se le denomina ENLACE METÁLICO. Los átomos así unidos solo forman cristales.
"Aquí" tienes una animación. En este "enlace" tienes otra animación.
Un resumen antes de seguir: consulta esta dirección de "iniciación interactiva a la materia".
También puedes ver este vídeo.
Actividad nº 4: Investiga la diferencia que hay entre las fórmulas de las verdaderas moléculas y la de los cristales o redes cristalinas y después explica el significado de las siguientes: CaF2, H2SO4, NaCl y HNO3.
Actividad nº 5: Las mitocondrias son los orgánulos celulares en los que tiene lugar la Respiración Celular, son como las centrales energéticas de las células porque lo que hacen es extraer la energía que se haya contenida en los nutrientes, para ello deben romper numerosos enlaces químicos. Este proceso necesita de la presencia de una gas ¿sabes de qué gas se trata?. Si quieres saber más sobre las mitocondrias pincha "aquí".
Actividad nº 6: Prueba tus conocimientos con esta "autoevaluación".
Como resumen esta presentación.



No hay comentarios:
Publicar un comentario
Se ruega ser educado.